2025-05-09
基因编辑技术作为现代生物医学领域的革命性突破,正在深刻改变我们对生命科学的认知。自2012年CRISPR-Cas9基因编辑工具首次提出来,基因编辑技术迅速成为生命科学研究的热门领域。这一技术通过模拟细菌的免疫机制,利用特定的RNA引导Cas9蛋白在目标DNA位置进行切割,从而实现基因的精准编辑。近年来,基因编辑技术不断迭代发展,进一步拓展了基因编辑的应用范围。
基因编辑工具递送载体是实现基因编辑技术的关键环节,它们负责将基因编辑组件(如Cas9蛋白、gRNA等)精准地递送到目标细胞中,从而确保基因编辑的成功。递送载体的选择和使用直接影响编辑效率和安全性。当前,基因编辑工具递送领域中的代表性载体包括病毒类载体(如腺相关病毒AAV)和非病毒类载体(如脂质纳米颗粒LNP)。然而,这些载体各有优缺点。例如AAV载体在治疗过程中可能因Cas9蛋白长期表达而增加脱靶风险和免疫原性。而LNP载体虽然安全性高,但主要在肝脏中积累,导致肝外组织中递送效率较低。
在此背景下,病毒样颗粒(VLPs)技术凭借其独特优势成为新一代递送平台的研究焦点。VLPs是一种由病毒外壳蛋白自组装而成的颗粒结构,具有病毒的外观和功能,但不含病毒遗传物质。因此,它结合了病毒递送载体和非病毒递送载体的优势,成为极具吸引力的基因编辑器递送载体。在基因编辑领域,用于递送mRNA或蛋白的VLPs大多是基于慢病毒或逆转录病毒,与其他递送载体相比,VLPs具有以下优势:
负载灵活性:未成熟的逆转录病毒颗粒缺乏刚性对称结构,可提高装载物的灵活性。慢病毒/逆转录病毒颗粒直径100-200nm可兼容mRNA、RNP等多种形式载荷。
靶向可塑性:通过病毒包膜糖蛋白修饰实现组织特异性递送。
脱靶率低:瞬时递送模式显著降低脱靶效应。
安全性高:VLPs完全由蛋白质组装而成,不含DNA,避免了病毒遗传物质整合至宿主细胞基因组的风险。
劲帆医药VLPs一站式解决方案
劲帆医药致力于为全球学术界、制药公司和生物技术企业提供VLPs一站式服务,已搭建覆盖从基础研究到临床前应用的全流程技术平台,支持VLPs的工程化改造与定制化生产,包含但不限于VLPs纯化、靶向性改造、多维度检测及个性化定制的全链条CRO服务。
蔡宇伽团队的突破:VLPs递送mRNA技术
早在2018年蔡宇伽团队开发了一种慢病毒载体递送外源RNA的技术(专利号CN108504689A),该技术利用RNA结合蛋白(MS2)和其所识别的RNA序列(MS2 stem loop)相互结合的原理,将MS2蛋白整合至慢病毒GagPol长链蛋白的骨架中,并将其所识别的MS2 stem loop序列连接到外源目的RNA,从而使目的RNA在慢病毒颗粒的组装过程中被包装进慢病毒颗粒。在这项技术中,MS2蛋白与慢病毒结构蛋白Gag融合表达并位于N端,MS2 stem loop位于EGFP的N端,以达到更高的递送效率,如下图所示。
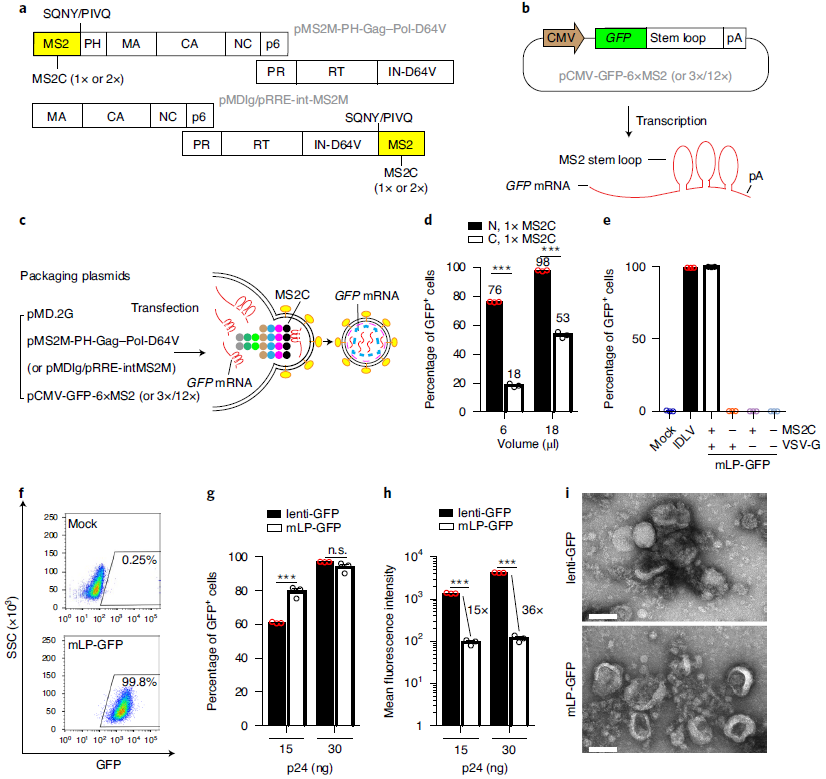
图1 构建一种有效递送mRNA的慢病毒系统
(图片来源:Ling S et al, Nat Biomed Eng., 2021)
基于这一技术,蔡宇伽团队在2021年先后在《Nature Biotechnology》和《Nature biomedical engineering》期刊上发表研究型论文,旨在利用慢病毒样颗粒(VLPs)递送Cas9 mRNA和sgRNA,以实现基因编辑器的高效递送。该技术递送的Cas9蛋白仅在体内表达约72小时,显著降低了Cas9蛋白长时间表达所引起的脱靶效应。在治疗小鼠疱疹病毒性角膜炎方面,该技术也表现良好。随后,蔡宇伽团队将此技术进行转化,开发出BD111,并于2022年6月获得了美国FDA孤儿药资格批准,目前已完成I期临床试验3例“复发性I型单纯疱疹性基质型角膜炎”受试者的给药。经18个月的初步临床观察和评估,未发生严重不良事件,且患者反应良好。下图为BD111药物设计以及抗病毒机制。
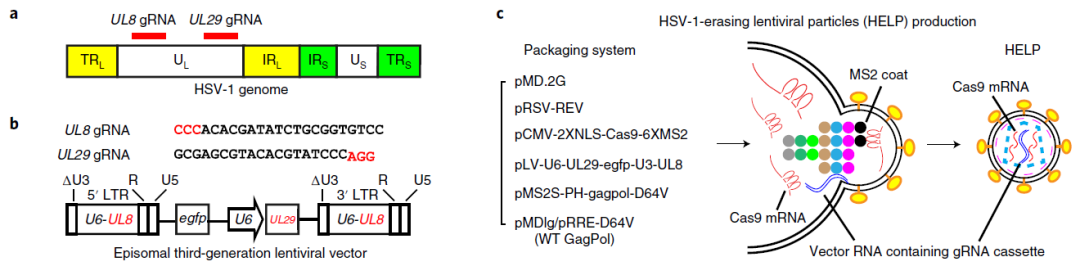
图2 BD111药物设计
(图片来源:Yin D et al, Nat Biotechnol., 2021)
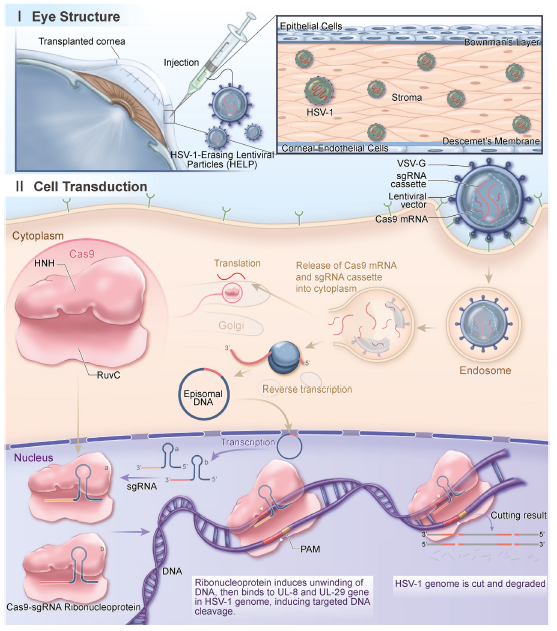
图3 人角膜HELP中CRISPR的抗病毒机制
(图片来源:Wei A et al, Mol Ther., 2023)
张锋团队领衔开发全新mRNA递送系统——SEND系统
2021年,张锋团队在《Science》期刊上发表研究型论文,成功开发出一种全新RNA递送平台-SEND系统。SEND系统是以人体内天然存在的RNA运输蛋白PEG10为核心,该蛋白具有与自身mRNA结合的能力,并能在其周围形成保护性囊状结构,为慢病毒系统Gag蛋白。为了将PEG10开发为递送平台,研究人员对PEG10进行了改造。首先他们在PEG10的mRNA序列中找到了识别和包装其RNA的序列,然后对PEG10蛋白和该mRNA序列进行改造,以便PEG10能够选择性包装RNA。为了增强PEG10系统进入细胞的能力,研究人员利用VSV-G和SYNA蛋白修饰PEG10蛋白,赋予了其感染多种细胞的能力。由于PEG10是天然存在于人体中的蛋白质,该平台相较于其他RNA递送方案可以有效避免机体的免疫攻击。
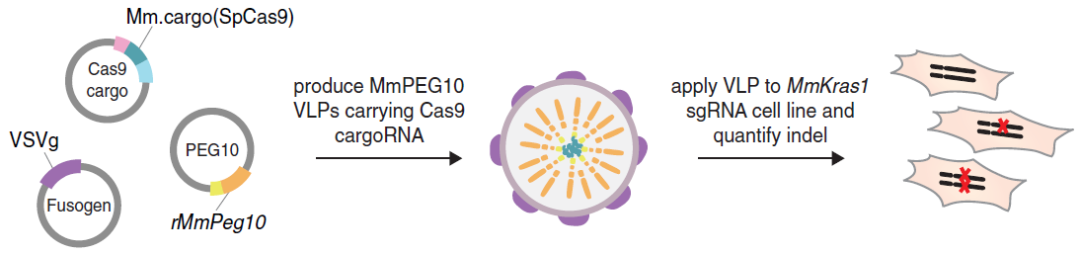
图4 SEND系统的基因工程改造
(图片来源:Segel M et al, Science, 2021)
David Liu团队突破eVLPs递送BE和PE编辑器
2022年,David Liu团队在《Cell》期刊上发表研究型论文,系统地优化了限制BE-VLPs递送效率的因素,最终获得第四代eVLP系统。与最初的报告系统相比,eVLP v4将BE RNPs包装量提高了16倍。体内实验结果显示,eVLP v4在293T细胞中的编辑效率可达95%,在NIH3T3细胞中的编辑效率可达80%,在原代人和鼠成纤维细胞中的编辑效率可达90%。同时,eVLP v4显著降低了脱靶效率。另外,eVLP v4在小鼠肝脏中实现了63%的细胞编辑效率,同时将血清中PCSK9水平降低了78%。此外,eVLP递送的BE显著改善了遗传性失明小鼠模型的视力状况。
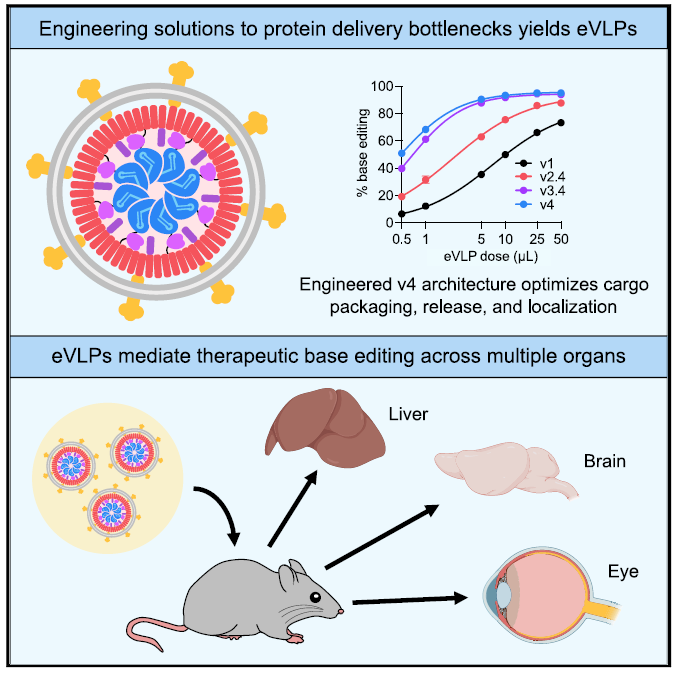
图5 工程化病毒样颗粒(eVLPs)实现多器官碱基编辑
(图片来源:Banskota S et al, Cell, 2022)
在最新的研究中,David Liu团队将eVLP v4系统和PE(PE是由nCas9和逆转录酶融合而成,通过pegRNA引导,可以在哺乳动物细胞中精准实现基因组替换、插入和删除)结合,并在此基础上进行优化,开发出PE-eVLP系统。与eVLP v4系统相比,v3和v3b PE-VLPs在小鼠脑神经瘤(N2A)中的启动编辑效率提高了79倍,在人胚肾细胞(294T)中提高了170倍。体内实验结果表明,v3 PE-VLPs在rd6小鼠视网膜变性模型中可以校正Mfrp基因的4bp缺失(平均编辑效率为15%)。在Leber先天性黑蒙2型的rd12小鼠模型中可校正RRE65基因突变(平均编辑效率为7.2%),从而部分恢复小鼠的视觉功能。
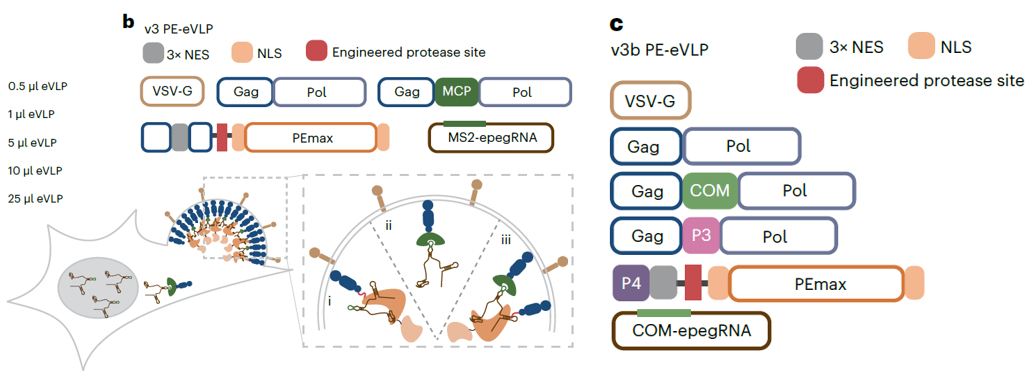
图6 v3与v2.3 PE-eVLPs中MCP–MS2策略及MS2茎环插入结构示意图
(图片来源:An M et al, Nat Biotechnol.,2024)
Jennifer A. Doudna团队成功简化VLPs递送系统——miniEDV
尽管VLPs在基因治疗领域展现出了广泛的应用前景,但其由慢病毒/逆转录病毒衍生而来,保留了大量病毒蛋白组分,自身安全性仍需优化。2024年12月,Jennifer A. Doudna团队在《PNAS》期刊上发表研究型论文,通过系统性的机制研究,成功开发出简化版包膜递送载体(miniEDV)系统,在保持高效递送的同时,显著降低了生产复杂度。相较于传统VLPs,miniEDV删除了约80%的病毒残留序列(Gag蛋白部分序列以及整个Pol蛋白),体积缩小了25%,但仍保持与原始EDV相当的Cas9 RNP包装量。体外实验结果表明,miniEDV在人原代T细胞中,编辑效率提升了53%-107%。在293T细胞中,编辑效率较原始EDV提升2.5倍。
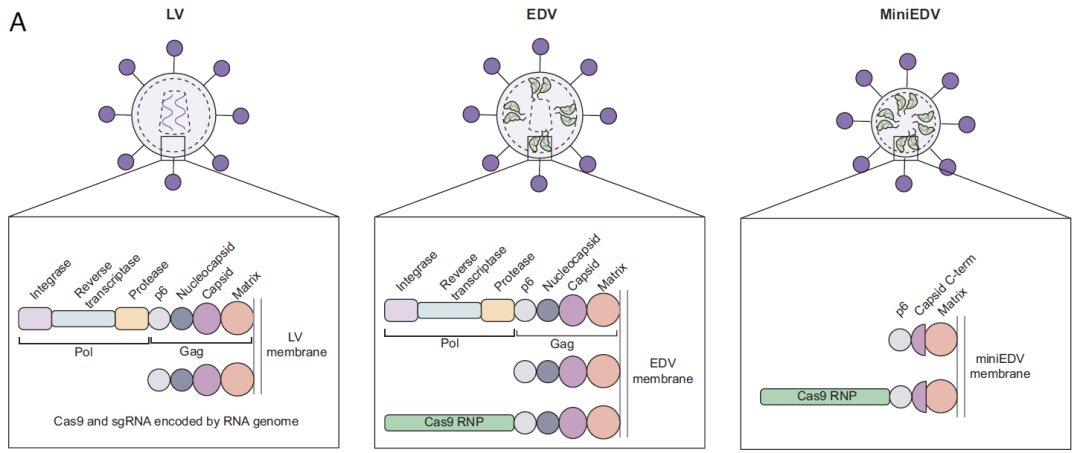
图7 LVs,EDV和最小化EDV(miniEDV)中的病毒结构蛋白示意图
(图片来源:Ngo W et al, Proc Natl Acad Sci USA., 2025)
VLPs技术正在重塑基因编辑递送格局,其发展轨迹印证了“仿生设计-工程优化-临床转化”的创新路径,VLPs的终极目标在于实现精准递送与生物安全的动态平衡。随着基础研究的持续突破和GMP生产体系的完善,这一技术有望为遗传病等领域带来突破性疗法。
参考文献:
1 Yin D, Ling S, Wang D, Dai Y, Jiang H, Zhou X, Paludan SR, Hong J, Cai Y. Targeting herpes simplex virus with CRISPR-Cas9 cures herpetic stromal keratitis in mice. Nat Biotechnol. 2021 May;39(5):567-577.
2 Ling S, Yang S, Hu X, Yin D, Dai Y, Qian X, Wang D, Pan X, Hong J, Sun X, Yang H, Paludan SR, Cai Y. Lentiviral delivery of co-packaged Cas9 mRNA and a Vegfa-targeting guide RNA prevents wet age-related macular degeneration in mice. Nat Biomed Eng. 2021 Feb;5(2):144-156.
3 Wei A, Yin D, Zhai Z, Ling S, Le H, Tian L, Xu J, Paludan SR, Cai Y, Hong J. In vivo CRISPR gene editing in patients with herpetic stromal keratitis. Mol Ther. 2023 Nov 1;31(11):3163-3175.
4 Segel M, Lash B, Song J, Ladha A, Liu CC, Jin X, Mekhedov SL, Macrae RK, Koonin EV, Zhang F. Mammalian retrovirus-like protein PEG10 packages its own mRNA and can be pseudotyped for mRNA delivery. Science. 2021 Aug 20;373(6557):882-889.
5 Banskota S, Raguram A, Suh S, Du SW, Davis JR, Choi EH, Wang X, Nielsen SC, Newby GA, Randolph PB, Osborn MJ, Musunuru K, Palczewski K, Liu DR. Engineered virus-like particles for efficient in vivo delivery of therapeutic proteins. Cell. 2022 Jan 20;185(2):250-265.e16.
6 An M, Raguram A, Du SW, Banskota S, Davis JR, Newby GA, Chen PZ, Palczewski K, Liu DR. Engineered virus-like particles for transient delivery of prime editor ribonucleoprotein complexes in vivo. Nat Biotechnol. 2024 Oct;42(10):1526-1537.
7 Ngo W, Peukes J, Baldwin A, Xue ZW, Hwang S, Stickels RR, Lin Z, Satpathy AT, Wells JA, Schekman R, Nogales E, Doudna JA. Mechanism-guided engineering of a minimal biological particle for genome editing. Proc Natl Acad Sci U S A. 2025 Jan 7;122(1):e2413519121.

地址:中国武汉东湖高新区光谷七路128号 市场:17720522078 人事行政:027-62439686 邮箱:marketing@genevoyager.com
BD 商务总台:17720514121 /13886000399(BD 经理) /17720515371(BD 经理)
本公司所有产品仅供实验科研使用,不用于人体疾病治疗及临床诊断。